 2021年7月に「ビジュアルスノウの精神症状について(日本語訳)」と題された、論文が公表されました。今回の記事では、当論文の内容をご紹介します。こちらの論文は、下記のような方におすすめですので、該当する方はぜひ最後までご覧ください!
2021年7月に「ビジュアルスノウの精神症状について(日本語訳)」と題された、論文が公表されました。今回の記事では、当論文の内容をご紹介します。こちらの論文は、下記のような方におすすめですので、該当する方はぜひ最後までご覧ください!
・ビジュアルスノウは先天性と後天性で違いがあるの?
・新しい治療法の詳細について知りたい
なお、わかりやすさ・読みやすさ重視のため、原文の内容を編集しています(補足文章の追加や見出しの増設・移動など)。編集なしのものが読まれたい方は、ご自身で原文を当たってください。各見出しに記載した英語が、原文の該当する箇所を示しています。
The Psychiatric Symptomology of Visual Snow Syndrome | Frontiers(ビジュアルスノウの精神症状について)
※ビジュアルスノウの諸症状の詳細については、こちらの記事にてご確認いただけます。
とは-320x180.jpg)
概要(Introduction)
目的
visual snow syndrome(VSS、ビジュアルスノウ症候群)の精神症状の特徴を明らかにし、quality of life (QOL、生活の質)や視覚症状の重症度との関係を解明する。
・生活の質とは?(医学的な意義とは?)
QOL=Quality of life(クオリティ オブ ライフ)は「生活の質」「生命の質」などと訳され、患者様の身体的な苦痛の軽減、精神的、社会的活動を含めた総合的な活力、生きがい、満足度という意味が含まれます。
がんの治療を受けている患者様は、病気の進行に伴う食欲不振、貧血、呼吸困難、むくみ、痛みなどといった不快な症状に加え、抗がん剤による吐き気、脱毛、白血球の減少や、手術を受けたあとの機能低下・損失といった副作用に悩むことがあります。その中でも、いかに自分らしい生活をするかといった点に着目してその質を高めることをQOLの向上といいます。
引用元:よくあるご質問「QOL(生活の質)の向上とはどのようなものですか?」の回答 | 東京ミッドタウン先端医療研究所
方法
125名のVSS患者を対象に、うつ病・不安症、離人症、睡眠の質、疲労、QOLを評価する一連の質問票と、視覚・感覚症状についての構造化臨床面接を実施した。
・構造化臨床面接とは?
構造化面接法と臨床面接とが合わさった概念。
・構造化面接法とは?
構造化面接法は、あらかじめ質問票をつくり、それにしたがって、同じ言葉づかいと同じ順序で質問する方法である。… 構造化面接法は、面接者の主観の入る余地が少なく、誰に対してもいつも同じ聞き方をするので、結果が信頼できる。
引用元:実証にもとづく臨床心理学と心理アセスメン ト | J-Stage
・臨床面接とは?
心理臨床の現場で診療を目的に行われる面接のこと
結果
VSS患者は、不安症やうつ病、離人症、疲労、睡眠不足を高い割合で示し、QOLに大きな影響を与えていた。また、精神症状、とくに離人症は、視覚症状の重症度の増加との関連が見られた。精神症状の重症度や頻度は、片頭痛の有無、患者の性別、VSSの発症時期(生涯発症と後期発症)によって有意な差はなかった。
・生涯発症=先天性(生まれたときから)
・後期発症=後天性
結論
精神症状はVSS患者に多く見られ、視覚症状の重症度の上昇やQOLの低下と関連している。重要なことは、生涯VSSの患者は、発症時期が遅い患者と比較して、精神症状を経験する可能性が同じであるにもかかわらず、苦痛のレベルが低く、視覚症状の自己評価が軽いことである。
このことは、VSSの精神症状は、視覚症状による苦痛だけが原因ではないことを示唆している。VSSの視覚症状に対する一貫した効果的な治療法はないが、精神症状については治療できる見込みがあり、それにより患者のQOLや視覚症状への対処能力を大幅に改善する見込みがある。
また当論文では「治療法はない」と断言されていますが、このことについては「最後に」で触れています。
序論(Introduction)
VSSの精神症状を、有効なアンケートと構造化インタビューを組み合わせて、大規模な患者集団を包括的に分析した。具体的には、精神症状の頻度を調べ、精神症状同士や視覚症状との関係を評価した。
さらに、精神症状の重症度が、片頭痛の状態、砂嵐症状の発症時期、性別によって異なるかどうかを評価した。最後に、精神症状が視覚症状の頻度と重症度に与える影響と、QOLとの関連性を調べた。
本研究の結果は、VSS患者を診療する医療従事者に重要な情報を提供し、この障害のより効果的な治療を可能にする治療法を特定するのに役立つと考えられる。
方法・方式(Methods)
患者の募集方法
参加者は、オンライン・ラジオ・テレビなどの広告や神経科医からの紹介によって集められた。
参加者の様態
下記の診断基準および国際頭痛分類の基準(1)をもとに、参加者がVSS患者であることを予め確認した。
「VSSの診断には、砂嵐症状が3ヵ月以上継続し、反復視、強化された内視現象、羞明、夜盲症のうち少なくとも2つの視覚症状があること」(原文より抜粋)

また、Short-Form 36 Health Survey(”生活の質”を測るもの)のグローバルスコアおよびサブスケールの正常な範囲を決定するため、41名の健常者に参加してもらった。(対象者の平均年齢は27.2歳。男性が15名(36.6%)、女性が26名(63.4%)。)
研究方法
それぞれの症状の度合いを測るうえでは、下記の尺度・指標が使われた。(「尺度」「指標」は、各項目の度合いを測るために使われる、チェックシート・質問票。)
・うつ病と不安症の尺度:DASS(Depression Anxiety Stress Scale)
一般的に使用されているうつ病と不安症の尺度で、直前1週間の自己申告による否定的な感情を評価するもの
・離人症の尺度:CDS(Cambridge Depersonalisation Scale)
過去6ヵ月間の自己申告による離人症の経験を測定するもの
・睡眠の質の指標:PSQI(The Pittsburgh Sleep Quality Index)
過去1ヵ月間の睡眠の質を評価するもの
・疲労度の尺度:FSS(Fatigue Severity Scale)
日々の疲労を評価するもの
・QOL(生活の質)の尺度:Short-Form 36 Health Survey Version 2(SF-36)
身体機能、身体的問題による役割制限、社会的機能、身体的苦痛、精神的健康、感情的問題による役割制限、活力、一般的な健康感を測定するもの
・砂嵐症状単体の重症度に関する調査
・視覚・非視覚症状に関する調査
結果(Results)
以下、結果の概要です。
片頭痛
・片頭痛患者は、片頭痛を持たない患者に比べて、視覚症状を訴える数が多かった。
・片頭痛患者は、羞明、反復視(過度の残像・トレイリング)を訴える割合が高かった。
性別
・女性は、男性よりも高いレベルの疲労度を示した。
・女性は、男性よりも砂嵐をより重症であると評価した。
VSSの発症
・後期発症のVSS患者は、生涯発症のVSS患者と比較して、砂嵐がより重症であると評価した。
・生涯VSS患者は、反復視(過度の残像・トレイリング)を報告する割合が低かった。
耳鳴り
・耳鳴りのある患者は、耳鳴りのない患者に比べて、視覚症状の数が多かった。
・砂嵐の評価は、そうでない人に比べて、より重症であると評価した。
VSS患者における各症状の割合
下記は、研究の結果判明した、各症状の発症割合です。各症状の英語⇔日本語については、こちらの記事をご確認ください。
とは-320x180.jpg)
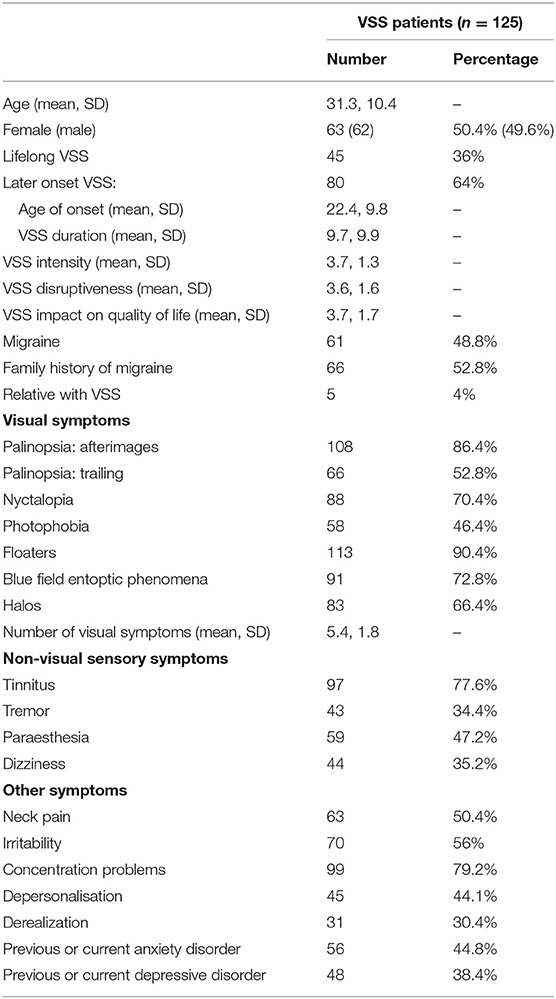
・mean=平均値、SD=標準偏差
・標準偏差とは、データの散らばりの度合を表す数値。平均年齢31.4で、標準偏差が(±:プラスマイナス)10.4の場合、被験者全体の約68%が「21歳~41.8歳」に該当することを意味する。
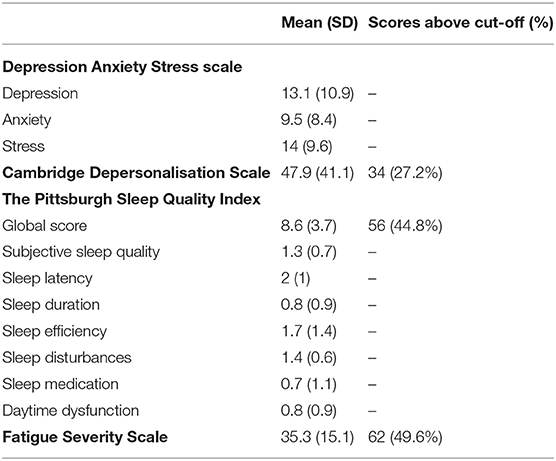
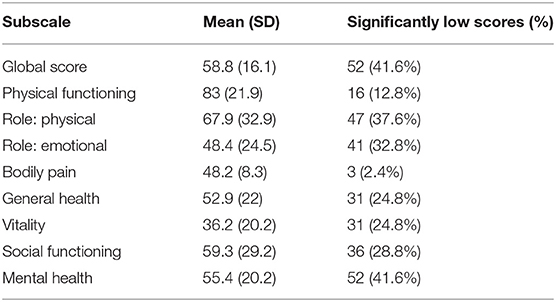
各尺度・指標の結果
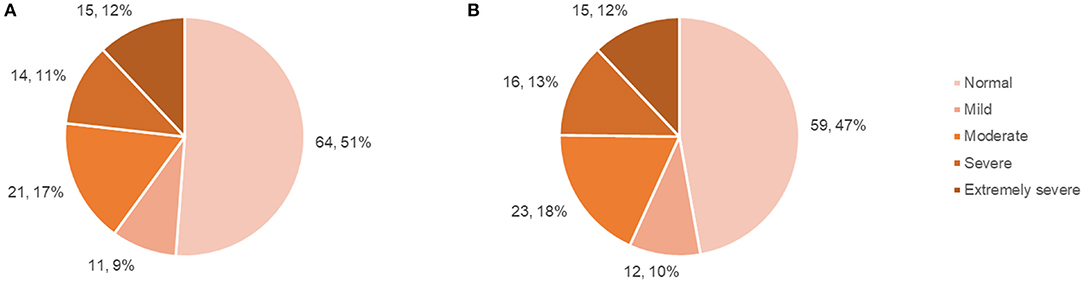
砂嵐症状の度合い
まとめ
VSS患者は、うつ病・不安症、離人症、疲労、睡眠不足を高い割合で示し、QOLに大きな影響を与えていた。
また、精神症状、とくに離人症は、視覚症状の重症度の増加との関連が見られた。
精神症状の重症度や頻度は、片頭痛の有無、患者の性別、VSSの発症時期(生涯発症と後期発症)によって有意な差はなかった。
ビジュアルスノウ患者の体験談(Patient Experiences of Visual Snow)
当論文の序盤~この章までは、「Visual Snow=砂嵐症状単体」「Visual Snow Syndrome=諸症状」との扱いになっていました。が、この章ではVisual Snowと表記がありながらも、内容は諸症状に焦点が当てられています。VSIに確認メールを送りましたが、当章ではとりあえず「VS=諸症状」として取り扱います。
ビジュアルスノウを悪化させた要因
症状を悪化させる「環境要因」と「個人的な要因」を特定した。
環境要因でもっとも多かったのは、薄暗がりや低照度の環境、眩しい人工光、日光、暗闇であった。
個人的な要因としては、疲労感、ストレス、不安感、飲酒、睡眠不足、運動、カフェイン、スクリーン使用などが挙げられた。
その他の要因としては、片頭痛、食生活の乱れ、脱水症状、病気、月経、違法薬物の使用などが挙げられた。
ビジュアルスノウを改善させる要因
症状を改善する要因として挙げられたもののなかで、もっとも多かったのは「睡眠の改善」であった。
次に多かったのは、「症状を受け入れる」、「症状を無視する」(見ているのではなく、スルーする)、「食事の改善」であった。
その他の要因としては、周囲の照明の変更、瞑想やマインドフルネスの実践、気分の改善(気分転換)、ストレスや不安の軽減、定期的な運動などが、少数ながらも挙げられた。
運動を挙げた患者は、「運動をすると、運動中に症状が強くなることがあるが、長期的には症状の感じ方を改善することにつながる」と説明していた。
光の影響を軽減するためにサングラスをかけているとの報告もあった。
2名の患者が、視覚症状を軽減するためにカラーレンズを着用していることを報告した(5)。
また別の2名の患者が、インターネットで見つけた砂嵐症状のリリーフ動画に2〜3分間集中することで、30秒程度有意に症状が緩和したことを報告したが、その効果が長続きするわけではなかった。
ビジュアルスノウの悪影響を受ける活動
運転
症状の悪影響を受ける活動として、もっとも多く声が上がったのは、車の運転だ。夜間や暗闇での運転が困難または不可能であるとの記述が多く見られた。また、道路標識が読めない、対向車のヘッドライトが明るすぎる、車のライトや街灯の残像が視界を妨げるとの回答もあった、
読書
読書が苦手な人も一定数おり、「必要な時以外は読まないようにしている」という声が多く上がった。また、画面操作の問題も多く、ある患者は「一日中パソコンに向かって仕事ができないので、仕事を辞めた」と答えていた。
その他多くの活動
症状の悪影響を受けるその他の要素としては、明るい日中に行われる社会活動およびスポーツ、夜間の外出、一時的な症状の悪化による身体活動、自然の風景や星空を楽しむことなどが挙げられた。また、「仕事、勉強、社会生活に影響がある」と大まかに答えた患者も多数いた。
※身体活動=運動未満、”安静”以上の動作
考察(Discussion)
VSSはいまだに理解されていない疾患であり、精神症状を頻繁に併発していることも知られていない。VSSの視覚症状を治療することは困難であり(10)、精神症状がどのように現れ、視覚症状とどのように関連しているのかを理解することは、患者の生活の質を大きく改善する治療の道を開くことになる。
今研究を通して、VSS患者がもっとも頻繁に訴える精神症状と、視覚症状や生活の質(QOL)との関係を明らかにした。その結果、VSS患者は、臨床的に有意なレベルの「抑うつ、不安、離人症、疲労、睡眠不足」を示すことが多く、QOLに大きな影響を与えていることがわかった。
さらに、これらの精神症状は、より重度の視覚症状と関連している。とくに離人症は、砂嵐症状の自己評価の重度化と関連している。興味深いことに、VSSの発症時期(生涯発症と後期発症)、片頭痛の有無、患者の性別は、精神症状の重症度に有意な影響を及ぼさないことがわかった。
うつ病と不安症(Depression and Anxiety)
うつ病と不安症について
これまでの報告(3、5、8)と同様に、かなりの割合の患者が高いレベルのうつ病・不安症を示し、全体的に精神的健康度が低かった(SF-36:精神的健康度サブスケール)。
DASSの結果では、25%の患者が重度または超重度のうつ病を発症し、25%の患者が重度または超重度の不安症を発症していた。
うつ病と不安症のスコアは、砂嵐症状の重症度と有意に関連することがわかった。他の神経疾患と同様に、これらの症状は、症状そのものに関する苦痛を反映しているか、あるいは特定の疾患の根底にある神経生物学的変化に関連していると考えられる(18, 19)。
・「特定の疾患の根底にある神経生物学的変化」とは?
他の病気には見られない、「ビジュアルスノウ/神経疾患」特有の精神症状のこと。
QOL(生活の質)について
VSSの視覚的症状が患者のQOLに与える影響は大きく、不安や抑うつのレベルが高くなる可能性がある。車の運転、読書、スクリーンの使用など、生活上の重要な活動に影響が出て、仕事や勉強に支障をきたすことも多く、VSSが原因で転職したり、進学を断念したりした患者もいる。
社会的機能について
社会的機能にも影響があるようで、約30%の患者がSF-36の「社会的機能サブスケール」のスコアが著しく低いと報告している。社会活動やレクリエーション活動もVSSの影響を受ける可能性がある。例えば運動や飲酒をしたり、明るい場所・暗い場所に身を置いたりすることなどにより一時的に症状が悪化するため、それらの要素を含む活動を避けるようになる。また、視覚症状が不安で外出ができないという患者も見られた。
症状以外のストレス要因について
視覚症状による苦痛や影響に加えて、精神的な健康に影響を与える要因は数多くある。VSSはまだ広く認知されておらず、理解されていない。多くの患者は自分の症状に対する診断や説明を見つけるのに苦労している。患者は、自分の症状が心因性のものであると言われたり、仮病であると推測されたりすることがよくある(5, 20)。
総評
この研究に参加した患者の中には、正体不明の脳がんではないか、視覚症状がどんどん悪化して失明してしまうのではないか、という不安を抱いていた人たちがいた。
VSSと診断されても、現在利用できる治療法がほとんどないため、大半の患者は症状が改善されない(10)。これらの要因により、VSS患者にはうつ病・不安症が多いと考えられる。
今回の結果から、VSS患者のうつ病・不安症は、必ずしも感覚障害に起因する二次的なものではなく、少なくとも部分的には、この障害に固有のものである可能性が示唆された。
生涯VSS患者の砂嵐症状の程度は平均的であるため、「後天的に発症した患者に比べてうつ病・不安症のレベルが低い」と、私たちは当研究の前に予想していた。これを裏付けるように、生涯VSS患者は、発症時期が遅い患者に比べて「砂嵐症状が軽度であり、生活の質への影響が少ない」と報告している。また、大人になるまで視界の異常に気づかなかった人が多くいることもわかった。
一方、主観的には症状をあまり気にしていないにもかかわらず、生涯VSS患者は、後発の患者と同等レベルの憂鬱感や不安感を訴えていた。
また、睡眠の質、疲労度、離人症、健康関連のQOLについても、両グループに差はなかった。このことから、VSSが精神衛生、睡眠、活力の程度に及ぼす悪影響は、VSSの症状による苦痛だけに起因するものではないと考えられる。

離人症(depersonalisation)
離人症(CDS)スコアは、砂嵐の重症度や経験した症状の数にも大きく影響することがわかった。
離人感について
「離人感」とは、肉体や精神的なプロセスから切り離された主観的な感情のことで、”ロボット”のような感覚を伴うことがある(24)。
離人症について
一時的な離人感は一般の人にもよく見られるが、それが繰り返し起こり、苦痛を伴う場合には、「離人症」の診断が検討される(9)。
本研究では、VSS患者の45%近くが離人感の経験があると回答し、25%以上が離人症の可能性を示す尺度のカットオフ値を超えていた(離人症の基準を満たしていた)。
このことから、VSSでは離人症が一般的であるだけでなく、かなりの数の患者で重症化していることが示唆される。
現実感喪失について
周囲の世界が非現実的または人工的であると感じる、「現実感喪失」についても、30%の患者が報告していた。
睡眠と疲労(Sleep and Fatigue)
睡眠機能障害について
VSSの睡眠障害はこれまで報告されていなかったが、今回行った研究では頻繁に訴えられ、40%以上の患者が睡眠機能障害を示す睡眠尺度(PSQI)のスコアを示した。
VSS患者は、目を開けていても閉じていても、暗闇での視覚症状が気になって眠れないことをしばしば訴えていた。睡眠障害は、入眠までの時間が長くなる「睡眠潜時(すいみんせんじ)」だけではなく、睡眠の質の低下、睡眠効率の低下などについても高い割合で見られることがわかった。
睡眠不足とうつ病や不安症との関係について
一般的に、睡眠は、うつ病や不安症と確実に双方向の関係を示しており(21)、睡眠不足は、精神的な健康状態を悪化させるものである。実際に今回の研究においても、睡眠不足は、うつ病や不安症の割合の高さと関係があった。
多くの患者が砂嵐症状の悪化要因として睡眠不足を挙げていることから、患者の睡眠障害に対処することで、「精神的な健康」と「視覚症状への耐性」の両方が改善・強化される可能性がある。
疲労感・無気力感について
疲労感や無気力感は、複数のVSS研究で報告されている(3、7)。興味深いことに、睡眠の質(PSQI)と疲労度(FSS)の間には有意な関係が見られなかった。このことから、VSS患者が報告する高レベルの疲労は、単に睡眠不足の結果ではないことが示唆された。
疲労は、片頭痛をはじめとする他の神経疾患でも多く見られ(22, 23)、片頭痛の重さや機能障害の重さと関連している(22)。VSSでも同様の関連性が示唆されていることがわかった。疲労度が高いほど視覚症状の数も多くなり、VSの重症度のスコア(自己評価)も高くなった。
しかし、疲労が感覚障害への対処の結果として生じているのか、疲労レベルが高い患者は視覚症状を無視できずに悪化していると認識しているのか、あるいは疲労がVSSの病態に直接関連しているのかは、まだ不明である。
VSSの病態生理学(Pathophysiology of VSS)
上述した通り、精神状態の悪化や睡眠・疲労の問題が、VSSの一次的な症状なのか、感覚障害の二次的な症状なのかは不明であるが、根本的な原因は共通していると考えられる。
VSSの病態はいまだに解明されていないが、感覚情報の処理における中枢(最も大事なところ)の障害が関与していると考えられている(3、5、20)。…
本研究の限界
本研究の限界としては、「募集が偏っていること」と「VSSの諸症状の重症度を客観的に測定する方法がないこと」が挙げられる。
症状に強い影響を受けている患者は、研究に参加しようとするモチベーションが高く、偏向的に、より重篤な症状を報告する可能性がある。
また、症状の自己評価は、症状の重さだけでなく、症状に対する苦痛も反映していることからも、純粋に客観的であるとは考えにくい。実際、多くの患者が、精神症状の変化(例えば、不安の度合いや睡眠の質の変化)によって、視覚症状の認識が悪化したり改善したりしたと報告している。
治療法(Treatments)
QOLの改善について
VSSに伴う精神症状を治療することは、視覚症状の改善を伴うか否かにかかわらず、患者のQOLを大きく改善する可能性が高い。
睡眠機能障害の治療について
睡眠機能障害は、生活習慣の改善、行動療法、薬物療法など、さまざまなアプローチで治療可能である(42)。睡眠とメンタルヘルスには双方向の関係があるため、睡眠機能障害に対処することで、うつ病や不安症の改善につながる可能性もある(21)。
うつ病や不安症の治療について
また、VSSでは重度のうつ病や不安症が多いことから、重度の精神疾患や自殺の危険性がある患者を特定し治療することも重要である。睡眠障害と同様に、これらに対しても、薬理学的、心理学的に多くの治療法がある(43, 44)。
離人症の治療について
離人症の治療に関する研究はほとんど行われていないが、VSSにもっとも効果があると考えられている薬(10)であるラモトリギンが、この症状の治療に役立つ可能性があるといういくつかの証拠がある(45)。認知行動療法(CBT)など、うつ病や不安症の治療に一般的に用いられる心理療法も、患者の視覚症状への対処に役立つ可能性がある。
耳鳴りの治療について
これまでVSSの治療に心理学的アプローチを検討した研究はないが、CBTに基づく耳鳴りの治療については豊富な研究がある。
耳鳴りは、VSS患者の大半が訴える症状であり、VSの聴覚的な類似性、すなわち、各感覚系において低レベルの “ノイズ “が常に知覚されていることを意味すると理論化されている(3)。
耳鳴りとVSの類似性や患者の重複を考慮すると、耳鳴りに有効な治療法はVSSにも有効であると考えられる。
CBTには様々な認知療法や行動療法があるが、簡単に言えば、「耳鳴り(あるいはVS)の知覚」のような、出来事や経験に対するバイアスのかかった不合理な反応を特定し、修正することを目的としている(46)。
CBTを用いた抑うつ、不安などの治療について
CBTは、耳鳴り患者のうつ病や不安症、不眠、および健康関連の総合的なQOLを有意に改善することが示されている(47)。耳鳴りを治療するために開発されたCBTの形式は、VSSに適用しても効果があるかもしれない。
結論(Conclusion)
本研究の結果、VSSは患者のQOLに大きな影響を与え、身体的および精神的な健康の様々な側面に影響を与えることがわかった。
うつ病や不安症、離症人、睡眠障害、疲労、社会的機能の低下などが患者に多く見られ、これらのスコアが低い(重症である)ほど、視覚症状の自己評価も低い(重症である)傾向があった。
生涯患者と後期発症患者の同等のQOLスコアは、精神的健康、疲労、睡眠障害が、この疾患に部分的に固有のものである可能性を示している。しかし、感覚的な症状が引き起こす感情的影響(ストレス)によってこれらの症状が悪化することについては、間違いないと言える。
患者は、睡眠不足、疲労、不安が砂嵐症状を悪化させると報告している一方で、睡眠を改善し、ストレスや不安を軽減することで、症状に対する認識が改善する(主観的に症状の負担が軽減する)とも言っている。
VSSに有効な治療法がほとんどないことを考えると、関連する精神的・身体的な症状を治療することが、一部のケースにおいて、患者を支援する唯一かつもっとも有効な方法の可能性がある。
また、患者のメンタルヘルスや睡眠を治療することは、患者の生活の質を向上させ、視覚症状の認識を改善することにつながるだろう。
資金調達(Funding)
諸事情につき、資金調達については、下記記事で解説しています。

最後に(当サイトより)
以上が今回の論文内容です。この記事を読まれた方は、どのような感想を抱かれましたか?
などと、色々な考え方があるでしょう。私は、自身の症状が非常に鬱陶しいと思いつつも、2番目・3番目の考え方です。これを読まれている方が、どのような解釈をするのかは当然ながらご自身の感性にお任せします!
なお、当サイトの別記事で紹介した治療法については、あくまでも「今は論文に掲載・紹介できる段階ではない」です。それ以上でもそれ以下でもありません。
先日紹介したとおり、あちらの研究も進展していっており、学会発表を2022年に控えています。また、1~2年後には、今回のような形式で詳細な報告・解説がなされるでしょう。ですので、変に悲観的にならず、楽しみに待っておく位のスタンスが精神衛生上よろしいかもしれません!(^^)

その他
発行者情報
受理日:2021年4月30日 承認日:2021年6月28日
発行日:2021年7月30日
著者
Emma J. Solly(1), Meaghan Clough(1), Paige Foletta(1), Owen B. White(1,2) and Joanne Fielding(1,2)*
1:Department of Neuroscience, Central Clinical School, Monash University, Melbourne, VIC, Australia
2:Department of Neurology, Alfred Health, Melbourne, VIC, Australia
編集者
Heather E. Moss, Stanford University, United States
査読者
Michael S. Vaphiades, University of Alabama at Birmingham, United States
Silvia Colnaghi, University of Pavia, Italy
※査読者:論文が一定の水準に達しているかを審査する人
倫理規定
参加者を対象とした本研究は、モナッシュ大学人間研究倫理委員会の審査を受け、承認された。本研究への参加については、参加者から書面によるインフォームド・コンセントを得ている。
※インフォームド・コンセント=医師が患者と十分な話し合いをしたうえで得た合意
著者の貢献度
JF、MC、OW、ES、PFは、本研究の構想と設計に貢献した。データの取得はESとPFが担当した。ESは原稿の第一稿を書いた。JF、MC、OWはプロジェクトを監督し、原稿の重要な修正に関与した。著者全員が論文に貢献し、提出されたバージョンを承認した。
発行者からのお知らせ
本論文で述べられているすべての主張は、単に著者の主張であり、彼らの関連組織の主張、発行者、編集者、査読者の主張を必ずしも代表するものではありません。
参考文献(References)
1. The International Classification of Headache Disorders 3rd edition. Cephalalgia. (2013) 33:629–808. doi: 10.1177/0333102413485658
2. Puledda F, Schankin C, Goadsby PJ. Visual snow syndrome: a clinical and phenotypical description of 1,100 cases. Neurology. (2020) 94:e564–74. doi: 10.1212/WNL.0000000000008909
3. Schankin CJ, Maniyar FH, Digre KB, Goadsby PJ. ‘Visual snow’ – a disorder distinct from persistent migraine aura. Brain. (2014) 137 (Pt 5):1419–28. doi: 10.1093/brain/awu050
4. Schankin CJ, Maniyar FH, Sprenger T, Chou DE, Eller M, Goadsby PJ. The relation between migraine, typical migraine aura and “visual snow”. Headache. (2014) 54:957–66. doi: 10.1111/head.12378
5. Lauschke JL, Plant GT, Fraser CL. Visual snow: a thalamocortical dysrhythmia of the visual pathway? J Clin Neurosci. (2016) 28:123–7. doi: 10.1016/j.jocn.2015.12.001
6. Solly EJ, Clough M, McKendrick AM, Foletta P, White OB, Fielding J. Ocular motor measures of visual processing changes in visual snow syndrome. Neurology. (2020) 95: e1784–e1791. doi: 10.1212/WNL.0000000000010372
7. Metzler AI, Robertson CE. Visual snow syndrome: proposed criteria, clinical implications, and pathophysiology. Curr Neurol Neurosci Rep. (2018) 18:52. doi: 10.1007/s11910-018-0854-2
8. Yildiz FG, Turkyilmaz U, Unal-Cevik I. The clinical characteristics and neurophysiological assessments of the occipital cortex in visual snow syndrome with or without migraine. Headache. (2019) 52: 58–63. doi: 10.1111/head.13494
9. Michal M, Adler J, Wiltink J, Reiner I, Tschan R, Wolfling K, et al. A case series of 223 patients with depersonalization-derealization syndrome. BMC Psychiatry. (2016) 16:203. doi: 10.1186/s12888-016-0908-4
10. van Dongen RM, Waaijer LC, Onderwater GLJ, Ferrari MD, Terwindt GM. Treatment effects and comorbid diseases in 58 patients with visual snow. Neurology. (2019) 93: e398–e403. doi: 10.1212/WNL.0000000000007825
11. Abraham HD. Visual phenomenology of the LSD flashback. Arch Gen Psychiatry. (1983) 40:884–9. doi: 10.1001/archpsyc.1983.01790070074009
12. Lovibond SH, Lovibond PF. Manual for the Depression Anxiety & Stress Scales. 2nd ed. Sydney, NSW: Psychology Foundation (1995).
13. Sierra M, Berrios GE. The Cambridge Depersonalization Scale: a new instrument for the measurement of depersonalization. Psychiatry Res. (2000) 93:153–64. doi: 10.1016/S0165-1781(00)00100-1
14. Buysse DJ, Reynolds CF 3rd, Monk TH, Berman SR, Kupfer DJ. The Pittsburgh Sleep Quality Index: a new instrument for psychiatric practice and research. Psychiatry Res. (1989) 28:193–213. doi: 10.1016/0165-1781(89)90047-4
15. Carpenter JS, Andrykowski MA. Psychometric evaluation of the Pittsburgh sleep quality index. J Psychosom Res. (1998) 45:5–13. doi: 10.1016/S0022-3999(97)00298-5
16. Krupp LB, LaRocca NG, Muir-Nash J, Steinberg AD. The fatigue severity scale. Application to patients with multiple sclerosis and systemic lupus erythematosus. Arch Neurol. (1989) 46:1121–3. doi: 10.1001/archneur.1989.00520460115022
17. Ware JE Jr. SF-36 health survey update. Spine. (2000) 25:3130–9. doi: 10.1097/00007632-200012150-00008
18. Prisnie JC, Sajobi TT, Wang M, Patten SB, Fiest KM, Bulloch AGM, et al. Effects of depression and anxiety on quality of life in five common neurological disorders. Gen Hosp Psychiatry. (2018) 52:58–63. doi: 10.1016/j.genhosppsych.2018.03.009
19. Hesdorffer DC. Comorbidity between neurological illness and psychiatric disorders. CNS Spectr. (2016) 21:230–8. doi: 10.1017/S1092852915000929
20. White OB, Clough M, McKendrick AM, Fielding J. Visual snow: visual misperception. J Neuroopthalmol. (2018) 38:514–21. doi: 10.1097/WNO.0000000000000702
21. Alvaro PK, Roberts RM, Harris JK. A systematic review assessing bidirectionality between sleep disturbances, anxiety, and depression. Sleep. (2013) 36:1059–68. doi: 10.5665/sleep.2810
22. Maestri M, Romigi A, Schirru A, Fabbrini M, Gori S, Bonuccelli U, et al. Excessive daytime sleepiness and fatigue in neurological disorders. Sleep Breathing. (2020) 24:413–24. doi: 10.1007/s11325-019-01921-4
23. Chaudhuri A, Behan PO. Fatigue in neurological disorders. Lancet. (2004) 363:978–88. doi: 10.1016/S0140-6736(04)15794-2
24. Simeon D, Kozin DS, Segal K, Lerch B, Dujour R, Giesbrecht T. De-constructing depersonalization: further evidence for symptom clusters. Psychiatry Res. (2008) 157:303–6. doi: 10.1016/j.psychres.2007.07.007
25. Baker D, Hunter E, Lawrence E, Medford N, Patel M, Senior C, et al. Depersonalisation disorder: clinical features of 204 cases. Br J Psychiatry. (2003) 182:428–33. doi: 10.1192/bjp.182.5.428
26. Yen Pik San F, Jauregui-Renaud K, Green DA, Bronstein AM, Gresty MA. Depersonalisation/derealisation symptoms in vestibular disease. J Neurol Neurosurg Psychiatry. (2006) 77:760–6. doi: 10.1136/jnnp.2005.075473
27. Jauregui Renaud K. Vestibular function and depersonalization/derealization symptoms. Multisens Res. (2015) 28:637–51. doi: 10.1163/22134808-00002480
28. Jauregui-Renaud K, Ramos-Toledo V, Aguilar-Bolanos M, Montano-Velazquez B, Pliego-Maldonado A. Symptoms of detachment from the self or from the environment in patients with an acquired deficiency of the special senses. J Vestib Res. (2008) 18:129–
29. Toupet M, Van Nechel C, Hautefort C, Heuschen S, Duquesne U, Cassoulet A, et al. Influence of visual and vestibular hypersensitivity on derealization and depersonalization in chronic dizziness. Front Neurol. (2019) 10:69. doi: 10.3389/fneur.2019.00069
30. Lopez C. A neuroscientific account of how vestibular disorders impair bodily self-consciousness. Front Integr Neurosci. (2013) 7:91. doi: 10.3389/fnint.2013.00091
31. Kremkow J, Alonso JM. Thalamocortical circuits and functional architecture. Annu Rev Vis Sci. (2018) 4:263–85. doi: 10.1146/annurev-vision-091517-034122
32. Ward LM. The thalamus: gateway to the mind. Wiley Interdiscip Rev Cogn Sci. (2013) 4:609–22. doi: 10.1002/wcs.1256
33. Llinas R, Ribary U, Contreras D, Pedroarena C. The neuronal basis for consciousness. Philos Trans R Soc Lond B Biol Sci. (1998) 353:1841–9. doi: 10.1098/rstb.1998.0336
34. Zobeiri M, van Luijtelaar G, Budde T, Sysoev IV. The brain network in a model of thalamocortical dysrhythmia. Brain Connect. (2019) 9:273–84. doi: 10.1089/brain.2018.0621
35. Timofeev I, Bazhenov M. Mechanisms and biological role of thalamocortical oscillations. Trends Chronobiol Res. (2005) 1–47. doi: 10.4249/scholarpedia.1319
36. Vesuna S, Kauvar IV, Richman E, Gore F, Oskotsky T, Sava-Segal C, et al. Deep posteromedial cortical rhythm in dissociation. Nature. (2020) 586:87–94. doi: 10.1038/s41586-020-2731-9
37. Llinas RR, Ribary U, Jeanmonod D, Kronberg E, Mitra PP. Thalamocortical dysrhythmia: a neurological and neuropsychiatric syndrome characterized by magnetoencephalography. Proc Natl Acad Sci USA. (1999) 96:15222–7. doi: 10.1073/pnas.96.26.15222
38. De Ridder D, Vanneste S, Langguth B, Llinas R. Thalamocortical dysrhythmia: a theoretical update in tinnitus. Front Neurol. (2015) 6:124. doi: 10.3389/fneur.2015.00124
39. Hodkinson DJ, Wilcox SL, Veggeberg R, Noseda R, Burstein R, Borsook D, et al. Increased amplitude of thalamocortical low-frequency oscillations in patients with migraine. J Neurosci. (2016) 36:8026–36. doi: 10.1523/JNEUROSCI.1038-16.2016
40. Vanneste S, Song JJ, De Ridder D. Thalamocortical dysrhythmia detected by machine learning. Nat Commun. (2018) 9:1103. doi: 10.1038/s41467-018-02820-0
41. Malekmohammadi M, Elias WJ, Pouratian N. Human thalamus regulates cortical activity via spatially specific and structurally constrained phase-amplitude coupling. Cereb Cortex. (2015) 25:1618–28. doi: 10.1093/cercor/bht358
42. Becker PM, Sattar M. Treatment of sleep dysfunction and psychiatric disorders. Curr Treat Opt Neurol. (2009) 11:349–57. doi: 10.1007/s11940-009-0039-z
43. Malhi GS, Bell E, Bassett D, Boyce P, Bryant R, Hazell P, et al. The 2020 Royal Australian and New Zealand College of Psychiatrists clinical practice guidelines for mood disorders. Aust N Z J Psychiatry. (2021) 55:7–117. doi: 10.1177/0004867420979353
44. Andrews G, Bell C, Boyce P, Gale C, Lampe L, Marwat O, et al. Royal Australian and New Zealand College of Psychiatrists clinical practice guidelines for the treatment of panic disorder, social anxiety disorder and generalised anxiety disorder. Aust N Z J Psychiatry. (2018) 52:1109–72. doi: 10.1177/0004867418799453
45. Naguy A, Al-Enezi N. Lamotrigine uses in psychiatric practice. Am J Ther. (2019) 26:e96–102. doi: 10.1097/MJT.0000000000000535
46. Andersson G. Psychological aspects of tinnitus and the application of cognitive-behavioral therapy. Clin Psychol Rev. (2002) 22:977–90. doi: 10.1016/S0272-7358(01)00124-6
47. Landry EC, Sandoval XCR, Simeone CN, Tidball G, Lea J, Westerberg BD. Systematic review and network meta-analysis of cognitive and/or behavioral therapies (CBT) for tinnitus. Otol Neurotol. (2020) 41:153–66. doi: 10.1097/MAO.0000000000002472





-150x150.jpg)











毎度理解しやすく読みやすい記事でありがたいです!
先天性と後天性だと感じ方も違うので差が出てくるんですね…後天性の方がやっぱり前の視界を知ってるからこそ辛く感じるからなんですかね。
ビジュアルスノウの症状を測れたらより正確なデータが取れると思うのでぜひ研究頑張ってほしい…!
らいむさん温かいコメントありがとうございます!
そうですね。元の綺麗な景色と比較してしまうのが感じ方に強く影響を与えていそうです。
海外では測定器械、日本ではコントラスト感度を用いた研究が進められているので、その進展に期待です!